Электрический ток в электролитах

Транзисторы Обобщение и систематизация знаний Лабораторная работа 1 Лабораторная работа 2 Лабораторная работа Лабораторная работа 3 Лабораторная работа 4 Приложение. Модели атома. Ионов растворителя. Сегодня студентам предлагается провести опыт по заранее спланированной методике типа. Радиус определялся от точки ввода в магнит до точки касания в закруглении колбы.
Получившаяся молекула сульфата меди переходит в раствор. Это показывает прохождение электрического тока через водный раствор сульфата меди для растворения медного анода и оседания меди на катоде. Концентрация данного раствора не меняется. Электролиз водного раствора хлорида меди. В году М. Фарадеем был установлен закон электролиза. Закон Фарадея определяет количества первичных продуктов, которые выделяются во время электролиза на электродах.
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q , прошедшему через электролит:. Отсюда следует, что электрохимический эквивалент k равняется отношению массы m 0 иона данного вещества к его заряду q 0. Постоянная Фарадея численно равняется заряду, который следует пропустить через электролит, для выделения на электроде одного моля одновалентного вещества. Электричество Электромагнетизм.

Контрольная работа. Механика вращательного и колебательного движения. Справочник Онлайн-калькуляторы Тесты с ответами. Помощь студентам Справочник Физика Постоянный электрический ток Электрический ток в электролитах.
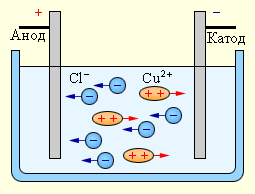
Как работает сервис. Положительные ионы, достигнув катода, соединяются со свободными электронами, поступающими из цепи.

Количество выделенного на электродах вещества G пропорционально количеству электричества, прошедшего через электролит, т. Он широко применяется для получения цветных металлов медь, алюминий из растворов их соединений. Электролиз применяется и для покрытия металлов защитным слоем другого металла например, хромирование. Такой процесс называется гальваностегией. С помощью электролиза можно защитить изделие металлическим покрытием. Электрический ток в электролитах передают ионы, образовавшиеся в результате электролитической диссоциации.
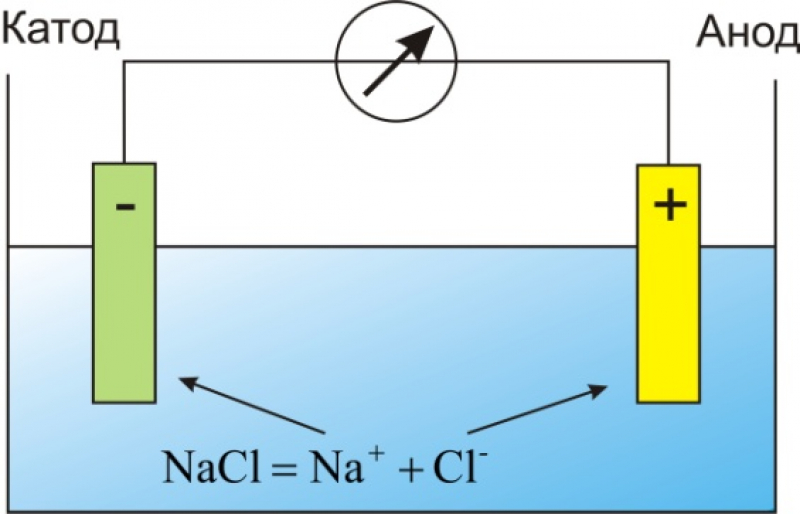
Положительно заряженные ионы — катионы — движутся к отрицательно заряженному электроду — катоду.
Отрицательно заряженные анионы устремятся к положительно заряженному электроду — аноду. Достигнув электрода, ионы нейтрализуются, превращаясь в атомы вещества, и оседают на электродах. Это явление было изучено Майклом Фарадеем и получило название электролиза. Электрический ток в электролитах.
Средняя оценка: 4. Что мы узнали? Молекул воды или температуры. Электрического тока.
Ионов растворителя. Начать тест.